66년생 국민연금 수령나이 및 66년생 국민연금 수령시기, 66년생 국민연금 납부기간 납부나이는 어떻게 될까요?
오늘은 66년생 국민연금 수령나이 및 수령시기, 66년생 국민연금 납부기간 납부나이는 어떻게 될까요? 대해 간단하게 알아볼게요. 국민연금 개편안 소식도 있지만 현재까지 66년생 국민연금 수령나이는 만 64세라고 하구요. 66년생 국민연금 조기수령은 만 59세부터이며 분할연금 수급개시연령은 만 64세부터라고 해요.

66년생 분들이 만 64세가 되는 해는 2030년이라고 하는데요. 따라서 66년생 국민연금 수령나이는 만 64세이며 66년생 국민연금 납부나이 납부기간에 따른 국민연금 개시일은 2030년도 본인 주민등록생일 월 다음달부터 국민연금 수령이 가능하다고 해요. 5월생이라면 6월부터 수령이 가능하구요. 국민연금 분할연금 또한 2030년도부터 가능하며, 국민연금 조기수령 조기연금은 만 59세가 되는 2025년부터 신청이 가능하다고 해요.
국민연금은 소득이 있는 국민이라면 의무 가입대상이 되는데요. 국민연금을 받기 위해선 최소 10년간 보험료를 납부해야 하구요. 수령 조건을 채웠다면 60~65세 부터 평생동안 매달 연금을 받게 되는데요. 참고로 연금을 오래 낼수록 연금 수령액도 그만큼 더해지게 된다고 해요.
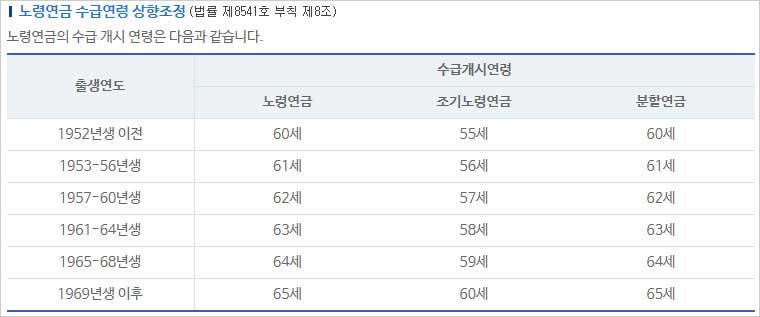
참고로 국민연금 노령연금을 받는 연령은 1952년생까지는 만 60세였다고 하는데요. 하지만 고령화 추세를 반영하여 1953~1956년생은 61세, 1957~1960년생은 62세, 1961~1964년생은 63세, 1965~1968년생은 64세, 그리고 1969년생 이후 출생자는 65세부터 노령연금을 수령하도록 1998년 말에 법이 개정되었다고 해요.
즉 2012년(1952년생 이전)까지만 해도 만 60세에 노령연금을 받았다고 하는데요. 하지만 2013년(1953년생부터)부터 만 61세로 늦춰졌다고 하구요. 또한 2018년(1957년생부터)부터는 만 62세로 수급연령이 늦춰졌으며, 1969년 이후 출생자의 연금수급개시 연령이 만 65세로 늦춰지게 됐다고 해요.
때문에 66년생 분들이 만 64세가 되는 해는 2030년이며, 2030년도 본인 주민등록생일 월 다음달부터 국민연금 수령이 가능한데요. 5월생이라면 6월부터 수령이 가능하구요. 국민연금 분할연금 또한 2030년도부터 가능하며, 국민연금 조기수령 조기연금은 만 59세가 되는 2025년부터 신청이 가능하다고 해요.
66년생 국민연금 수령나이 및 66년생 국민연금 납부기간, 납입나이에 따른 66년생 국민연금 수령시기는 언제일까요?에 대한 간단 내용 참고하셨으면 좋겠어요.